发布者:林章 发布时间:2022-09-13 动态浏览次数:10
在与病原微生物的长期抗争中,植物进化出双重天然免疫系统,即病原体相关分子模式触发的免疫(PAMP-triggered immunity,PTI)和病原体效应蛋白触发的免疫(Effector-triggered immunity,ETI)。免疫受体准确识别多样化的病原体成分是植物发挥抗性的先决条件。NLR(Nucleotide-binding domain and leucine-rich repeat containing receptor)是调节ETI的一类主要受体蛋白,可以直接或间接地识别病原微生物效应蛋白。根据其N端结构域的不同,NLR主要分为CNL(CC-NB-LRR)和TNL(TIR-NB-LRR)两大类。CNL间接识别效应蛋白后可以形成抗病小体,发挥离子通道功能引起ETI,而其直接识别机制尚未可知。
2022年9月9日,Science Advances在线发表了我中心欧阳松应课题组关于秆锈菌效应蛋白AvrSr35激活小麦抗病蛋白Sr35的最新研究成果,论文标题为 “Pathogen effector AvrSr35 triggers Sr35 resistosome assembly via a direct recognition mechanism ”,揭示了病原菌效应蛋白AvrSr35激活抗病蛋白Sr35功能机制。

该研究证实单粒小麦(Triticum monococcum)的CNL蛋白Sr35可直接识别来自秆锈真菌(Puccinia graminis f. sp. tritici)Ug99的效应蛋白AvrSr35,并分别通过冷冻电镜技术和X-射线衍射晶体学技术解析了Sr35抗病小体结构和AvrSr35的晶体结构。结构分析和生化实验结果表明,AvrSr35通过与Sr35的LRR结构域直接相互作用,在ATP的辅助下形成由Sr35-AvrSr35异源二聚体复合物组装而成的环状五聚体蛋白,即Sr35抗病小体(图1)。ATP分子结合在NOD结构域中部,位于基序P-loop的K206和TT/SR的R311为NLR蛋白结合ATP γ磷酸基团的保守氨基酸位点。晶体结构显示AvrSr35在溶液中为同源二聚体构象,其二聚界面与结合Sr35的相互作用界面完全重合,结合体外生化实验和植物生理学实验结果,该研究发现Sr35对AvrSr35的直接识别会引起AvrSr35二聚构象的解离。
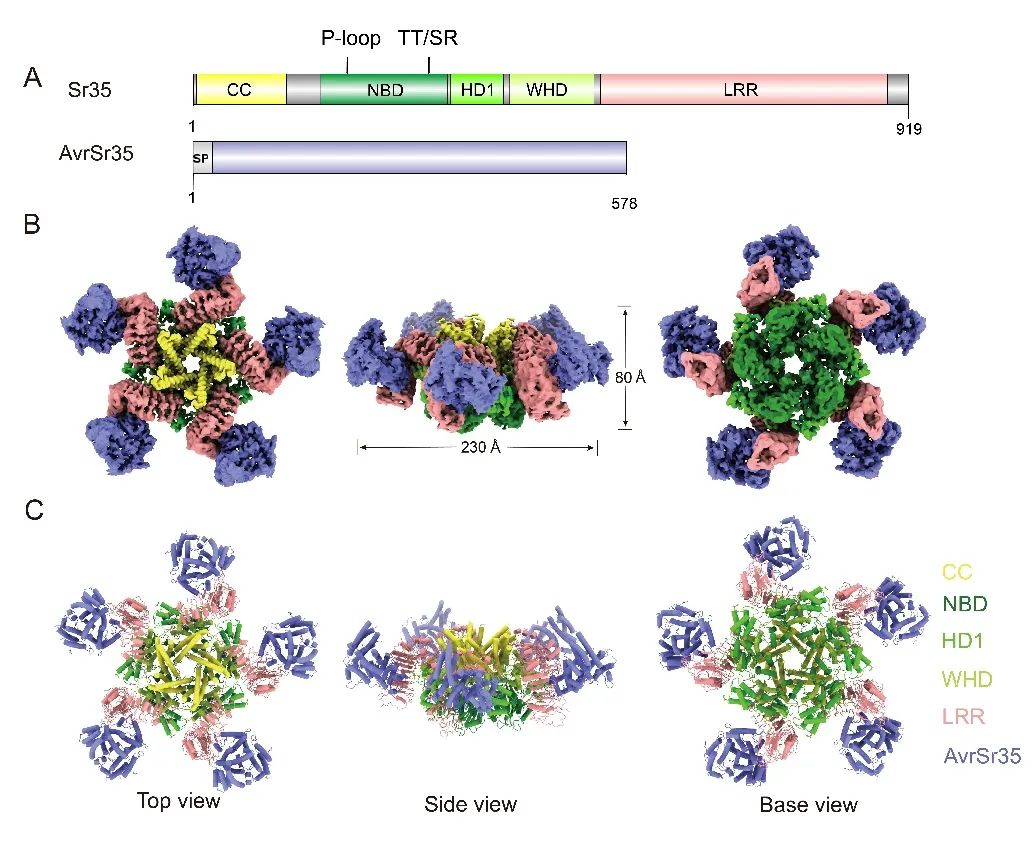
图1. Sr35抗病小体整体结构
在Sr35抗病小体中,CC结构域的三螺旋束相互堆积形成“漏斗”状构象扣在圆环结构上方。“漏斗”底部关键疏水氨基酸Y141A的突变体抑制了五聚构象的组装,也消除了其在叶肉细胞中的死亡诱导活性,故CC结构域的寡聚对Sr35介导的抗病功能具有关键作用。另外,该研究发现Sr35的1-20位氨基酸的截短突变体Sr3520并不抑制抗病小体的组装但阻隔了免疫信号的传导。烟草叶肉细胞的亚细胞定位结合质壁分离实验以及拟南芥原生质体定位分析显示,Sr35激活各阶段均与细胞膜相关联,包括突变体Sr3520,说明Sr35免疫活性的发挥或与细胞质膜有紧密联系,也说明了Sr35的1至20位氨基酸是Sr35介导的免疫所必需的,但与质膜无关。该研究结果揭示了植物CNL的直接识别和激活机制(图2),暗示了环状五聚或许是激活态CNLs的普遍现象,并为Sr35抗病小体的生化功能提供了见解。
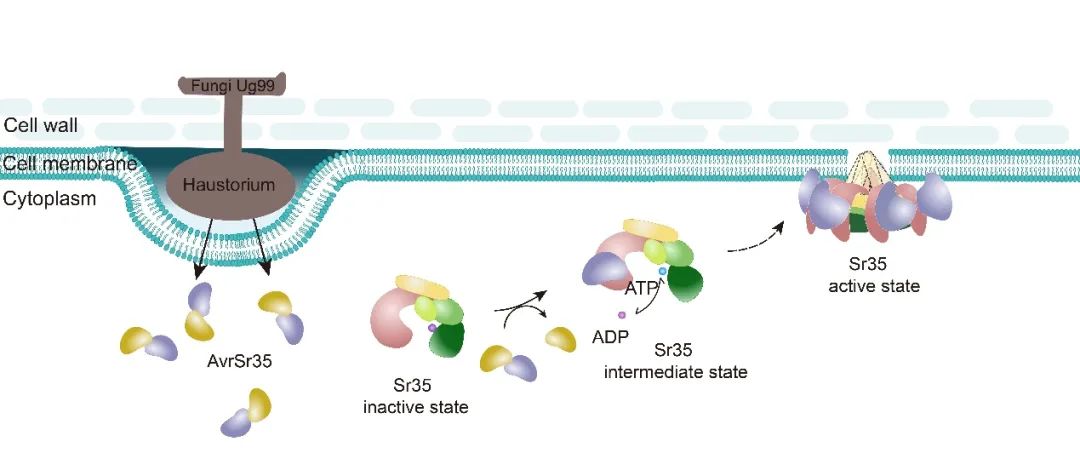
图2. AvrSr35诱导Sr35抗病小体的组装模型
福建师范大学生命科学学院、南方生物医学研究中心博士研究生赵燕波、刘梦茜及博士后陈涛涛为本文的共同第一作者。福建师范大学生命科学学院、南方生物医学研究中心欧阳松应教授和南方科技大学电镜中心王培毅教授为本文的共同通讯作者。
论文链接:https://www.science.org/doi/10.1126/sciadv.abq5108